低炭水化物食や断続的断食による減量メカニズムの解明―ケトン体の新たな受容体を発見―
低炭水化物食や断続的断食による減量メカニズムの解明
―ケトン体の新たな受容体を発見―
国立大学法人中国竞彩网大学院農学研究院応用生命化学部門の教授 木村郁夫らの研究グループは、低炭水化物食や断続的断食がもたらす体脂肪重量の効率的な減少効果に、飢餓のようなエネルギー不足時にグルコースの代替エネルギー源として産生されるケトン体の一種であるアセト酢酸とその受容体、そして腸内環境の変化が密接に関わっていることを明らかにしました。ケトン体とその受容体を介した分子栄養メカニズムの解明は、栄養管理による先制医療や予防医学、更にはケトン体受容体を標的とした代謝性疾患治療薬の開発に向けて、今後、本成果の応用が期待されます。
本研究成果は、米国科学アカデミー紀要(PNAS)(11月4日付)に掲載されます。
報道解禁日:11月5日 5時0分(日本時間)
論文タイトル:Ketone body receptor GPR43 regulates lipid metabolism under ketogenic conditions(ケトジェニック環境下、ケトン体受容体GPR43は脂質代謝を制御する)
URL: https://www.pnas.org/content/early/recent
現状
ケトン体(主にβヒドロキシ酪酸とアセト酢酸)は、飢餓時のようなグルコースが枯渇した状態において肝臓で産生され、速やかに脳や他の組織でグルコースの代わりに利用される我々にとって非常に重要な代替エネルギーとして知られています。このうち、β-ヒドロキシ酪酸は単なるエネルギー源としてだけではなく、Gタンパク質共役型受容体(注1)であるGPR109AやGPR41を介してシグナル分子として生体生理機能にまで関わることが、我々の過去の報告を含めて明らかにされてきました。しかしながら、アセト酢酸の特異的な受容体については未だ発見されていませんでした。また、低炭水化物食(注2)や中鎖脂肪酸食(注3)のようなケトン体産生が誘導されるケトン食や断続的断食(注4)などは、寿命の延伸、効率的な減量効果や脳機能改善など、我々の健康に寄与することがマウス実験から期待されていますが、実際にケトン体によるその詳細な作用機序は不明な部分が多く残されていました。
研究体制
本研究は、中国竞彩网の宮本潤基特任助教(大学院農学研究院)、北野(大植)隆司特任講師(大学院農学研究院)、木村郁夫教授(大学院農学研究院/グローバルイノベーション研究院)らの研究グループと、慶應義塾大学、京都医療センターとの共同研究により実施されました。
研究成果
木村教授らは、モノカルボン酸リガンドスクリーニング(注5)により、Gタンパク質共役型受容体のひとつGPR43が、ケトン体の一種であるアセト酢酸の受容体であることを新たに発見しました。本来、GPR43は短鎖脂肪酸により活性化される受容体として知られており、生体のエネルギー代謝や免疫機能に重要な役割を果たしています。この短鎖脂肪酸は、我々の食事中に含まれる食物繊維等の難消化性多糖類から腸内細菌発酵によって作られる主要代謝物であることから、短鎖脂肪酸受容体GPR43は腸内細菌と宿主を繋ぐ重要な受容体として認識されてきました。
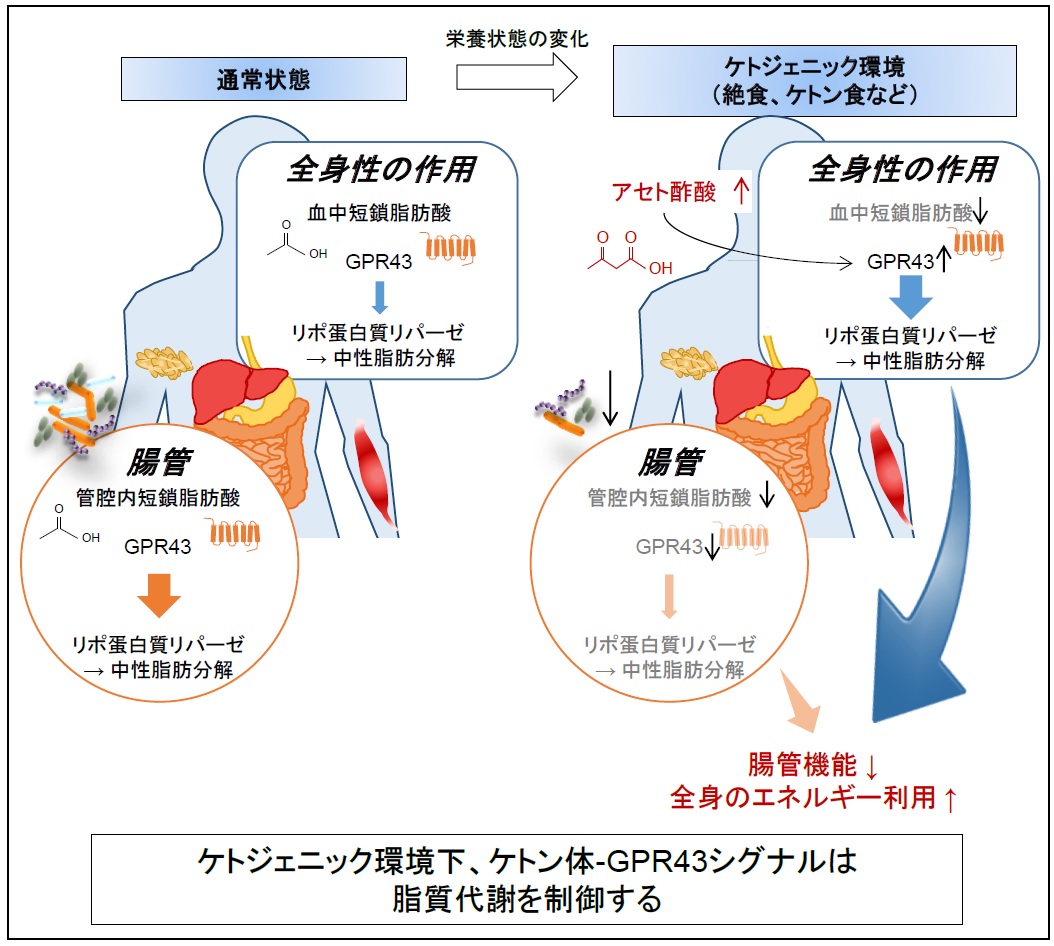
さらに、我々は、ケトジェニック(注6)環境下、ケトン体であるアセト酢酸によるGPR43刺激が、血中のリポ蛋白質リパーゼ(注7)の活性を高めることで中性脂肪の分解を促進し、効率的に脂肪酸を組織に取り込む結果、脂質の利用を高める、すなわち脂肪の消費を優先的に進めることを明らかにしました。
通常の状態では、このGPR43は、腸内細菌が食事に含まれる食物繊維を分解して産生する短鎖脂肪酸によって、腸管及び血中を介して全身で活性化されています。しかしながら、栄養状態の変化、すなわち、絶食、低炭水化物食や断続的断食を行うことにより、腸内細菌叢が変化し、この腸内細菌の短鎖脂肪酸の産生が腸管内では著しく減少することを見出しました。一方で、このようなケトジェニック環境において、血中ケトン体は、通常状態の短鎖脂肪酸血中濃度の10倍以上にも劇的に増加します。すなわち、ケトジェニック環境下、全身ではアセト酢酸を介し、GPR43は活性化される一方で、腸管では短鎖脂肪酸の減少によりGPR43が抑制される結果、全身での脂質代謝?エネルギー利用を亢進し、腸管では抑制されるという、栄養環境に依存した効率的エネルギー利用機構を明らかにしました(図)。この時、実際に、我々は野生型マウスで見られるような、低炭水化物食や断続的断食による体重上昇抑制効果が、Gpr43遺伝子を欠損させたGpr43ノックアウトマウスにおいて消失することも確認しました。
今後の展開
本研究により、飢餓(絶食)などのグルコースを正常に利用できないケトジェニックな環境や、断続的断食や低炭水化物食負荷において、腸内環境の変化や、ケトン体の一種であるアセト酢酸がGPR43を介して脂質代謝を制御することで、宿主のエネルギー恒常性に寄与することを明らかにしました。これらの知見は、栄養シグナル分子としてのケトン体の生体調節機能における中心的メカニズムを示唆することに繋がります。したがって、本研究の成果は、食事介入や栄養管理を介した先制医療や予防医学、さらにはケトン体受容体を標的とした代謝性疾患治療薬の開発に寄与する可能性が大いに期待されます。
(注1)Gタンパク質共役型受容体:細胞膜を7回貫通する細胞膜上受容体の一つ。細胞外のシグナル伝達物質を受容し、三量体のGタンパク質を介して細胞内にシグナルを伝達する。
(注2)低炭水化物食:炭水化物の摂取比率や量を制限した食事。
(注3)中鎖脂肪酸食:中鎖脂肪酸(Medium Chain Triglycerides; MCT)」を含む食事。
(注4)断続的断食:摂食を行うタイミングと絶食を行うタイミングを交互に設ける食事方法。
(注5)モノカルボン酸リガンドスクリーニング:カルボキシル基を一つ持つ有機化合物群の特定受容体に対する反応を、網羅的に評価する方法。
(注6)ケトジェニック:生体内でケトン体が上昇している状態。本論文では絶食、低炭水化物食や断続的断食などが該当する。
(注7)リポ蛋白質リパーゼ:中性脂肪を遊離脂肪酸とグリセロールに分解する脂質分解酵素。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業AMED-CREST「微生物叢と宿主の相互作用?共生の理解と、それに基づく疾患発症のメカニズム解明」領域(研究開発総括:笹川千尋)における研究開発課題「腸内代謝物に基づく宿主エネルギー恒常性維持への腸内細菌叢関与の解明と生活習慣病予防?治療基盤の確立」(研究開発代表者:木村郁夫)の一環で行われました。
◆研究に関する問い合わせ◆
中国竞彩网大学院農学研究院
応用生命化学部門 教授
木村 郁夫(きむら いくお)
TEL/FAX:042-367-5748
E-mail:ikimura(ここに@を入れてください)cc.tuat.ac.jp
http://web.tuat.ac.jp/~kimura/
◆事業に関する問い合わせ◆
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
TEL:03-6870-2224 FAX:03-6870-2246
E-mail:kenkyuk-ask(ここに@を入れてください)amed.go.jp
